ユニット紹介
生体防御教育研究部門
タンパク質科学ユニット
ユニットの目標
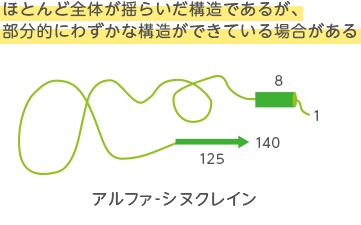
タンパク質の中には、構造を形成しないものがあります。そのタンパク質は天然変性タンパク質とよばれ、全タンパク質の30%以上をしめています。このタンパク質は構造形成して他のタンパク質と結合したり、凝集物を作ることがあります。このようなタンパク質を物理化学的に測定し、データ解析を行い、タンパク質の構造と機能の関連を考えています。
研究テーマ
- 核磁気共鳴装置から得られるデータをもとに、タンパク質の持つ揺らぎ運動を解析する。その揺らぎ構造と機能の関係を考える。
- 化学シフト値をもとに、変性タンパク質に残存する残存構造を明らかにする。残存構造と機能の関連を考える。
- アミノ酸配列より、揺らぎや折りたたみ中間体構造を予測する方法を考える。折りたたみ中間体と残存構造を比較して考える。
- タンパク質の揺らぎ構造と、オリゴマー形成とアミロイド形成の関連を考える。同一配列のタンパク質が環境により、異なる形態形成をとることを考える。
- アポミオグロビンの折りたたみ機構の解析を行う。タンパク質安定化と光異性化によるNMR構造解析を行う
発表論文
- Sato, Y., Matsugami, A., Watanabe, S., Hayashi, F., Arai, M., Kigawa, T., Nishimura, C. “Changes in dynamic and static structures of the HIV-1 p24 capsid protein N-domain caused by amino acid substitution are associated with its viral viability” Protein Sci. 30, 2233-2245, 2021
- Nishimura, C. “アポミオグロビンのフォールディング反応機構” 生物物理 60 (4), 215-221. 2020
- Okuwaki, R., Shinmura, I., Morita, S., Matsugami, A., Hayashi, F., Goto, Y. and Nishimura, C. “Distinct residual and disordered structures of alpha-synuclein analyzed by amide-proton exchange and NMR signal intensity” Biochimica et Biophysica Acta-Proteins and Proteomics 1868, 140464, 2020
- Nishimura, C.: “Folding of apomyoglobin: Analysis of transient intermediate structure during refolding using quick hydrogen deuterium exchange and NMR” Proc. Jpn. Acad., Ser. B 93, 10-27, 2017
- Sakurai, K.*, Yagi, M., Konuma, T., Takahashi, S., Nishimura, C., and Goto, Y.: “Non-native α-helices in the initial folding intermediate facilitate the ordered assembly of the β-barrel in β-lactoglobulin” Biochemistry 56, 4799-4807, 2017
- Konagaya, Y., Miyakawa, R., Sato, M., Matsugami, A., Watanabe, S., Hayashi, F., Kigawa, T., and Nishimura, C.*: “Effect of Glu12-His89 interaction on dynamic structures in HIV-1 p17 matrix protein elucidated by NMR” PLoS One 11, e0167176, 2016

