ユニット紹介
生体防御教育研究部門
生体制御ユニット
ユニットの目標
細菌やウイルス、化学物質などは、環境要因とともにさまざまな影響をヒトに及ぼしています。これらの性質と生体との関わりを理解し、活用することで多くの医薬品が開発されてきましたが、近年では新規医薬品創出の成功率の低下、これに伴う医薬品開発費の増大が問題となっています。本研究ユニットでは、抗体など生体機能制御に関わる分子や微生物、ナノマテリアル等を利用することにより、何らかの理由で医薬品として使われなくなっている既存のプロダクトの課題を克服する技術を開発し、新しい治療法を生み出すことを目指しています。
研究テーマ
細胞死誘導性アゴニスト抗体利用抗腫瘍薬開発
生体には不要な細胞などに細胞死を誘導し、除去する仕組みが備わっています。がん細胞に細胞死を誘導する生体内のリガンドやその受容体を標的とした抗体を利用することで、がん治療薬の開発が可能になると考えられます。薬効、安定性、安全性などに問題がある従来の抗体やリガンドについて、これらの課題を解決するため、分子量が小さく、安定性に優れた、ラクダ科動物であるアルパカ由来の一本鎖重鎖小分子抗体(VHH抗体)に着目し、薬効を強化し、安全性を高めたがん治療法の研究を行っています。
抗菌薬の感受性を高める一本鎖VHH抗体の開発
薬剤耐性菌の増加が世界的な問題となっていますが、新たな抗菌薬の開発は減少傾向にあります。病原細菌の耐性化により使用できなくなっている抗菌薬に対し、ラクダ科由来の一本鎖VHH抗体を抗菌薬の感受性を高める抗菌薬補助剤として使用する技術を開発しています。
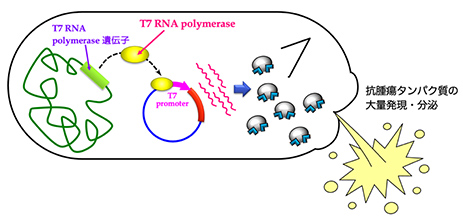
ビフィズス菌における組換えタンパク質の発現量を増大させる研究
腸内細菌として知られるビフィズス菌は偏性嫌気性であり、担がん動物の静脈内に投与すると腫瘍部位で選択的に増殖します。この性質に着目して、抗腫瘍タンパク質を発現・分泌するビフィズス菌を使ったがん治療法の開発を進めており、T7 RNAポリメラーゼ発現系をビフィズス菌に導入してさまざまな抗腫瘍タンパク質を効率よく発現させるシステムの確立を目指しています。
発表論文
- Kamiyama H., Nonaka C., Saitoh H., Ohno M., Shimizu Y., Isoda K. “Anatase and rutile titanium oxide nanoparticles induce acute kidney injury by coadministration with paraquat, cisplatin or 5-aminosalicylic acid.” Pharmazie 79(1), 2-5, 2024
- Ohno, M.K., Kirikae, T., Yoshihara, E., Kirikae, F. and Ishida, I. “Addition of L-cysteine to the N- or C-terminus of the all-D-enantiomer [D(KLAKLAK)2] increases antimicrobial activities against multidrug-resistant Pseudomonas aeruginosa, Acinetobacter baumannii and Escherichia coli.” PeerJ. 8, e10176, 2020
- Taira, I., Taira, Y., Kato, M., Shimizu, Y., Isoda, K., Saitou, H. and Ishida, I. “Reviving previous therapeutics by recombinant anaerobic bifidobacteria” Biomed. J. Sci. & Tech. Res. 12(5), 2019
特許
- 大野まき、石田功、切替照雄 「VHH抗体」国際特許出願 PCT/WO2023/112965 A1 (2023.6.22)
-
西川 毅、平 裕一郎、平 郁子、石田
功「組換え偏性嫌気性グラム陽性菌」
Nishikawa, T., Taira, Y., Taira, I., Ishida, I. “Recombinant obligate anaerobic gram-positive bacteria”
国際特許出願 PCT/WO2015/104994 (2015.7.16), 日本特許第6176683号 (2017.7.21), US10266601 (2019.4.23), CN105916975 (2020.8.7), 中華民国 I711699 (2020.12.1), US10882912 (2021.1.5), EP3093338 (2021.2.17) , EP3842050 (2024.6.12)
学会発表
- 志村 穂乃花、清水 美冬、切替 照雄、良原 栄策、西川 毅、石田 功、大野 まき:薬剤排出ポンプに結合するVHH抗体の作製と抗菌薬感受性増強効果 ; 日本薬学会第144年会、横浜、2024年3月
- 河西風菜、浅野達哉、荒木梓、斎藤浩美、磯田勝広:アルミナ修飾シリカナノ粒子の肝・腎傷害と相互作用に関する検討;日本薬学会第144年会、横浜、2024年3月
お知らせ
更新日 2025.04.01



